
| :: SCIENZA | ||
CRISPR/CAS9: LA FORBICE MOLECOLARE CON LA QUALE RISCRIVERE IL CODICE DELLA VITA
La storia di questa scoperta ha inizio nel 2011, quando Emmanuelle Charpentier, oggi direttrice del Max Planck Institute for Infection Biology di Berlino, allo scopo di sviluppare nuovi antibiotici studia la capacità dello Streptococcus pyogenes di neutralizzare i virus. Si imbatte invece per caso, come non è infrequente che accada per le grandi scoperte, in una molecola precedentemente sconosciuta, il tracrRNA, che fa parte dell’antico sistema immunitario dei batteri, Crispr-Cas9, che è in grado di rompere il Dna dei virus e quindi contrastarli. Charpentier pubblica il lavoro nel 2011 e in quello stesso anno contatta Jennifer Doudna, biochimica dell’Università della California di Berkeley, esperta di RNA. Si incontrano in un caffè a Puerto Rico e lì tutto ha inizio. Avviano una collaborazione che presto le porta a comprendere che per identificare il DNA di un virus è necessaria la fusione di Crispr-RNA (dove Crispr indica le “clustered regularly interspaced short palindromic repeats”, brevi ripetizioni palindrome raggruppate e separate a intervalli regolari) studiate da Doudna, con il tracrRNA della Charpentier e che Cas9 è la “forbice” che può tagliarne il genoma inattivandolo. L’anno seguente pubblicano un lavoro in cui mostrano di essere riuscite a riprogrammare il sistema Crispr-Cas9 in laboratorio, in modo da riuscire a dirigerlo su un sito predeterminato di qualsiasi DNA e modificare così il codice genetico. Vogliamo addentrarci in questo campo di studio così affascinante per capire qualcosa di più di questa straordinaria scoperta? Saranno tra poco trascorsi 70 anni da quel 28 febbraio 1953 quando Watson e Crick passarono alla storia per aver descritto il modello della struttura del DNA: la molecola della vita *. A partire da quella scoperta la genetica, scienza allora agli albori, trasse un impulso così grande che, in tempi relativamente brevi, furono fatti passi da gigante nella conoscenza del funzionamento del cuore della nostra essenza tanto che il 15 febbraio 2001 furono pubblicati i primi risultati del Progetto Genoma Umano, un'impresa scientifica straordinaria che cambiò per sempre il volto della medicina e che portò al completamento del sequenziamento dello stesso solo 3 anni dopo, nel 2003 **. Così come allora Watson e Crick ci avevano indicato la struttura, ora Craig Venter e Francis Collins ci dettagliarono la successione di nucleotidi che compongono l’intera molecola di DNA.
Ecco perché diventa interessante capirne funzionamento e applicazioni! Inizierò tracciando a grandi linee la storia di CRISPR in questo ultimo ventennio. All’inizio degli anni 2000, una serie di laboratori in Europa, dedicati alla ricerca di base, scoprirono che i batteri, le cellule più semplici esistenti, possiedono una sorta di sistema immunitario per difendersi dai virus patogeni dai quali sono attaccati. Un sistema immunitario molto diverso e naturalmente molto più semplice del nostro, ma davvero peculiare. Si tratta di una serie di quelle che sono state definite forbici molecolari programmabili – la più studiata delle quali è proprio l’enzima Cas9 – in grado di fare letteralmente a pezzi il materiale genetico infettivo, introdotto dai virus nel batterio con lo scopo di danneggiarlo. Ma sarà necessario attendere quasi altri 10 anni per comprendere nel dettaglio il funzionamento di Cas9, quando usciranno gli studi di biologi e biochimici delle Università di Berkeley e di Harvard, nella fattispecie Francisco Mojica, George Church insieme proprio a Emmanuelle Carpentier e Jennifer Doudna delle quali si è detto. Nel DNA dei batteri si trovano i loci genetici di CRISPR che sono formati da brevi successioni di nucleotidi (le basi del DNA: ATGC) ripetute e palindrome, disposte a intervalli regolari. Tali sequenze sono alternate a quelli che vengono chiamati “spaziatori” che sono invece a sequenza variabile. Di solito questi loci sono accompagnati da geni (Cas) che sono quindi associati a CRISPR. 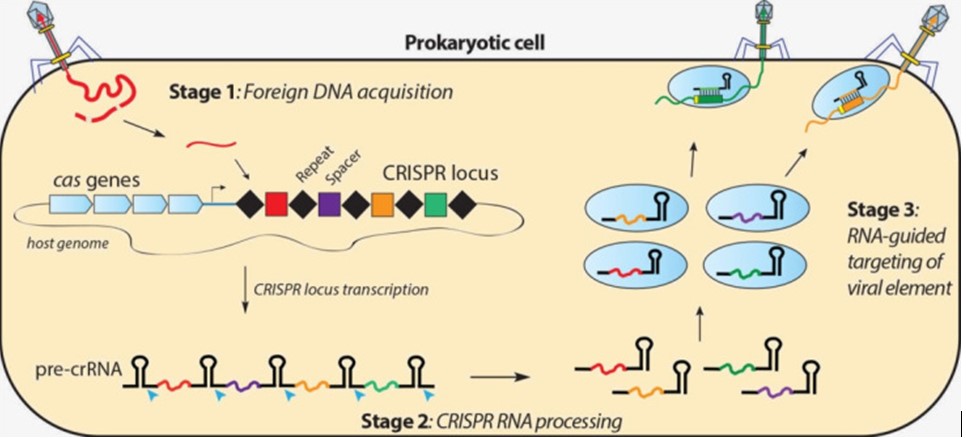
Normalmente quando un virus infetta il batterio vi inietta il suo DNA e, grazie a questo, riesce a produrre centinaia di nuovi virus che, dopo aver provocato la rottura e quindi la morte della cellula batterica, fuoriescono pronti per infettare nuove cellule. Ma se il batterio, per una qualche ragione, riesce a sopravvivere all’infezione ingloba il DNA virale nel proprio DNA e subito aggiunge proprio le sue sequenze ripetute CRISPR su entrambe i lati del DNA virale. In questo modo il batterio acquisisce informazioni su quel virus (cioè la sequenza del suo DNA) proprio come se avesse incamerato nel proprio data base la foto segnaletica di un nuovo criminale noto per la sua aggressività. E questo dato potrà anche trasmetterlo alla sua discendenza così che le generazioni successive saranno in grado di riconoscere quel virus ancor prima di venir attaccate e agire quindi tempestivamente. Blake Wiedenheft, ricercatore della Montana University, ha definito questa particolarità di CRISPR come una “tessera delle vaccinazioni genetiche delle cellule”. Ma come avviene tutto ciò nel dettaglio? Abbiamo detto che i batteri per proteggersi cercano di inattivare il DNA virale e lo fanno sintetizzando un RNA, replica esatta del DNA virale stesso. A questa molecola di RNA, appena creata, viene attaccato CRISPR (si chiama CRISPR RNA o crRNA), il complesso subito si associa a una proteina enzimatica chiamata Cas9 grazie alla quale riesce a muoversi e partire alla ricerca del DNA virale in tutta la cellula.
E’ parso subito chiaro come la funzione di riconoscimento e taglio insita nel complesso CRISPR/Cas9-RNA poteva essere sfruttata per modificare o cancellare qualsivoglia specifico frammento di DNA. E’ oggi possibile, infatti, programmare il sistema CRISPR/Cas9 in modo che sia capace di riconoscere uno specifico tratto di DNA precedentemente scelto all’interno di una cellula. La programmazione del bersaglio di Cas9 avviene attraverso una molecola di RNA, chiamata RNA guida, che può essere facilmente costruita in laboratorio e che, una volta associata a Cas9, agisce come una specie di guinzaglio, ancorandola alla sequenza di DNA bersaglio da noi scelta. Poi, una volta effettuato il taglio nella doppia elica, la stessa cellula interviene e ricuce il filamento del DNA (come fa ad esempio il nostro corpo umano in caso di una ferita), ricongiungendo la doppia elica o inserendo un’altra sequenza di DNA che sia stata resa disponibile dal ricercatore. Immaginiamo ora che il tratto che abbiamo appena tagliato contenga una mutazione che codifichi per la fibrosi cistica. Togliendo questo tratto potremmo di fatto eliminare la mutazione e con essa la patologia. Ecco che diventa fattibile rimuovere sequenze di DNA dannose oppure sostituirle, andando appunto a correggere delle mutazioni causa di malattia! Per quanto detto, risulta chiaro come l’avvento di CRISPR/Cas9 abbia per la prima volta reso sensato ipotizzare il trattamento di tutta una serie di patologie a base genetica per cui prima non era neppure possibile concepire un approccio terapeutico. Questa scoperta è stata una vera e propria rivoluzione per la ricerca biomedica, poiché per la prima volta si è riusciti ad introdurre nel genoma in modo semplice, efficace, veloce ed economico le modificazioni desiderate. A dimostrazione di ciò, l’utilizzazione di CRISPR/Cas9 in pochi anni si è diffusa nei laboratori di tutto il mondo e viene oggi impiegata sia per la ricerca di base che con scopi applicativi tant’è che, pur essendo una tecnologia ancora relativamente nuova e in forte evoluzione, la sua robustezza la sta spingendo rapidamente verso la sperimentazione clinica. Per la verità la modifica di geni in laboratorio si riusciva a ottenere già dagli anni ’80, ma prima dell’avvento di CRISPR/Cas non era così accurata e veniva eseguita principalmente in provetta. Oggi invece possiamo con una buona accuratezza programmare contro quale porzione di DNA far agire la forbice molecolare Cas9, inattivando così un gene specifico sia in cellule che in animali di laboratorio rendendo possibile in tal modo capirne, per esempio, la funzione. Questo approccio si chiama knock-out genico ed è molto usato, grazie ad esso la ricerca di base ha preso il volo poiché nulla è più indicativo della funzione di un gene che spegnerlo e poi osservare cosa succede. Da quando nel maggio del 2012 lo studio di Charpentier e Doudna è stato pubblicato sulla prestigiosissima rivista Science, il mondo della ricerca è stato investito da un’ondata di fermento come non si vedeva da tempo tanto che solo tre anni dopo la stessa rivista ha indicato CRISPR “scoperta dell’anno” e la ragione risulta chiara facendo una semplice ricerca su Pubmed. E’ immediatamente comprensibile come l’editing genomico comprenda un gran numero di applicazioni di ingegneria genetica che modificano la sequenza del DNA. Oggi gli scienziati possono agire come farebbe un correttore di bozze individuando i refusi del “testo DNA”, togliendo e sostituendo le sequenze geniche scorrette o indesiderate. Le strade che si aprono sono molteplici e all’orizzonte si intravede anche una nuova medicina indirizzata, almeno per i primi tempi, specialmente al settore delle malattie del sangue dove è relativamente agevole isolare le cellule malate per correggerle e restituirle al paziente. A tal proposito la sperimentazione clinica per la correzione delle cellule circolanti di pazienti affetti da beta-talassemia e anemia falciforme ha avuto inizio già nel 2019. In questi pazienti, nei quali per un’alterazione genica è presente un’emoglobina anomala, è stato inattivato il gene che blocca la produzione dell’emoglobina fetale (che dopo la nascita si interromperebbe) con lo scopo di compensare l’anomalia nel funzionamento del loro gene dell’emoglobina. Si auspica che i prossimi successi verranno dallo studio dei tumori del sangue, leucemie in primis, dove sarà possibile applicare una strategia simile per inattivare quei geni che promuovono lo sviluppo di questi tumori. Ma si può far funzionare CRISPR anche per modificare più di un gene in una volta sola; strategia questa utile laddove ci sia bisogno di un intervento radicale sul genoma di un organismo come nella generazione di maiali da cui prelevare successivamente tessuti da utilizzare per xenotrapianti. In questo caso vengono inattivate intere porzioni del corredo genico allo scopo di evitare reazioni di rigetto nei trapianti per es. di valvole cardiache. Una strategia simile è stata adottata da Venter, il pioniere della biologia sintetica usata per scopi biotecnologici. Usando CRISPR, il suo gruppo ha inattivato un gran numero di geni presenti nel genoma di un tipo di alghe capaci di produrre biodiesel. Poiché l’energia dei biocarburanti dipende dalla quantità di grassi prodotta da queste alghe, lo scopo delle modifiche era quella di identificare e inattivare i geni che limitassero la produzione di tali grassi aumentando di conseguenza la quantità di biodiesel prodotto. Un’altra applicazione interessante, che vede coinvolti anche laboratori italiani, è quella di produrre grano reso tollerabile per i pazienti celiaci, ottenuto disattivando tutti i geni che portano alla produzione di glutine. Ancora, in campo agronomico la creazione di patate più sicure ottenute inattivando quei geni che producono un composto tossico chiamato acrilamide. Non mancano gli approcci che permettono, al contrario, di inserire interi gruppi di geni utili. È il caso del golden rice, il riso OGM fortificato capace di produrre beta-carotene, un precursore della Vitamina A di cui molte diete sono carenti. Come si capisce una vera grande rivoluzione nei confronti della quale però si rende necessaria una riflessione poiché l’adozione di questa nuova tecnologia non è certamente esente da problemi di ordine pratico, economico ed etico. Infatti dal punto di vista tecnologico non si è ancora arrivati all’assoluta precisione, per cui il rischio di creare modifiche non volute che potrebbero comportarsi potenzialmente da mutazioni è per il momento ancora reale e attualmente sono necessari molti passaggi per produrre e selezionare con sicurezza organismi modificati o portare un agente terapeutico a colpire senza errore il suo bersaglio. Dal punto di vista economico, da anni assistiamo alla guerra dei brevetti per la proprietà intellettuale delle tecnologie CRISPR tra gli istituti pionieri nello sviluppo di questa tecnologia, l’università della California a Berkeley e il Broad Institute di Boston. Come si capisce gli interessi in gioco e le possibilità di guadagno future sono inestimabili. Un’altra partita importantissima è quella che si gioca a livello etico con le molte implicazioni dell’uso di CRISPR che derivano tutte dalla possibilità che l’uomo possa modificare per la prima volta nella storia sé stesso e gli altri organismi della biosfera. La preoccupazione per il rilascio nell’ambiente di nuovi organismi, per così dire “creati” dall’uomo tramite CRISPR, è molto sentita. Si pensi per esempio all’uso di CRISPR per eliminare il plasmodio della malaria tramite “gene drives” che è un approccio di manipolazione genetica che seleziona alcune caratteristiche ereditarie e che funziona come un acceleratore per la diffusione dei geni di interesse, in questo caso quelli che rendono sterili le femmine di zanzare che veicolano la malaria. Da un lato il rischio di perdere il controllo di CRISPR e delle sue modifiche, ma dall’altro vantaggi enormi. E non si pensi che ci si limiti agli insetti, in Australia e Nuova Zelanda stanno sviluppando strategie simili per il contenimento di popolazioni di roditori infestanti importati (ratti, conigli e altri) che hanno fortemente limitato la biodiversità del continente australe. Ma è in ambito medico che nascono i turbamenti maggiori se si considera la possibilità di creare modificazioni permanenti ed ereditabili nel genoma umano. Una cosa infatti è veicolare CRISPR per inattivare i geni mutati in un tumore, un’altra è veicolarlo in un embrione umano per correggere un difetto innato. Eppure la seconda applicazione è già tra di noi. Hanno già quasi tre anni infatti i primi bimbi-CRISPR cinesi in cui è stato inattivato il gene che li avrebbe resi suscettibili all’infezione da HIV. I loro embrioni sono stati ingegnerizzati da He Jiankui in un istituto di Shenzen, tramite fertilizzazione in vitro, per essere protetti dalle conseguenze di avere un padre HIV-positivo. E’ chiaro che per liberarci di molte malattie, in particolare quelle congenite, si debba inevitabilmente accettare di modificare il genoma ma è ancora più chiaro che in questo campo la bioetica deve avere un ruolo centrale. Certo pensare oggi, in tempo di pandemia da Sars/Cov2 a un mondo in cui lo “human recoding” ci abbia reso inattaccabili da altri organismi, in special modo i virus, è suggestivo ma non ci si scordi di quanto ci insegna Esiodo nella Gigantomachia quando racconta il mito dei Giganti, capeggiati da Alcioneo, che diedero la scalata all’Olimpo.
Edizione nr. 79, aprile 2021 |
||